| huozm32831 | 2016-09-06 09:17 |
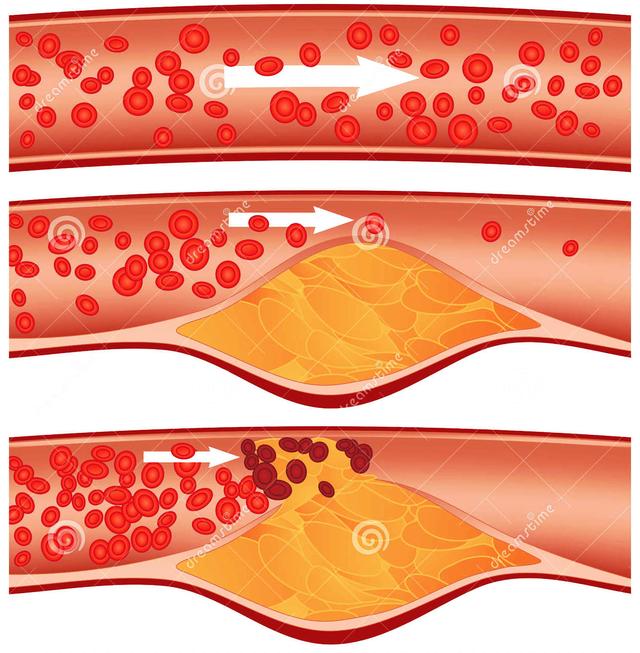 张俊海,解放军306医院,神经外科 动脉粥样硬化是一种古老的疾病,500年前埃及木乃伊的动脉中就已发现粥样硬化性病变。而人类认识动脉粥样是一种疾病并对其发病机制进行相关研究也有100余年的历史。随着社会的发展和生活水平的提高,感染性疾病所导致的死亡不断减少,而动脉粥样硬化疾病导致的死亡迅速增多,目前已成为全球人口死亡的首位原因。 血管不只是一个简单的解剖学管道,而是有着复杂功能的器官。早在100年前,Virchow等就认识到血管内皮细胞参与了动脉粥 样硬化的发生,并认为动脉粥样硬化是一种增生性疾病,而Rokitanshy等学者认为粥样斑块是血栓吸收和修复的结果。后来人们用髙脂饮食喂养动物诱发 出动脉粥样硬化,并认识到胆固醇尤其是低密度脂蛋白胆固醇 (LDL-C)参与了动脉粥样硬化的形成。近来人们发现有诸多炎症因子参与其疾病过 程,并认为动脉粥样硬化实质上是一种慢性炎症性疾病。对动脉粥样硬化病变认识上的进步可能带来防治上的突破。 动脉粥样硬化是心肌梗死和脑梗死等心血管事件发病的共同基础。其发病机制的研究上有几个重要学说,从不同层面反映了动脉粥样硬化的发病基础。  1 动脉粥样硬化的发病机制 1.1 动脉粥样硬化脂质浸润学说 动脉粥样硬化脂质浸润学说的提出是因为研究者看到斑块中的脂质沉积,认为这是血液中脂质水平增高而渗透到血管壁内所致。其包含以下3个过程: ①动脉内皮下脂质颗粒的蓄积与修饰 动脉粥样硬化的起始步骤目前还存在争议。动物实验显示,给与富含胆固醇和饱和脂肪酸的饮食,动脉内皮下很快就会出现以LDL为主的脂质颗粒的蓄积,这些 脂 质颗粒与内膜下蛋白多糖结合并有聚集的倾向,易发生脂质颗粒蓄积的部位与随后发生动脉粥样硬化的部位是一致的。许多因素可导致内皮损伤而使其对脂质颗粒的 通透性增加,可明显加快LDL颗粒的沉积速度。而影响LDL颗粒沉积速度更重要的因素是血浆LDL的浓度,浓度越高沉积速度越快,就越容易发生动脉粥样硬化,而动物实验显示如果LDL-C<80mg/mL,则较难诱导动脉粥样硬化的产生。动脉内皮下LDL等脂质颗粒的蓄积是动脉粥样硬化发生的必备条 件。 过多沉积的LDL等脂质颗粒需要依赖巨噬细胞的吞噬而清除,内皮下LDL首先需要进行化学修饰以区别于血液中正常运行的LDL,方便巨噬细胞 的识别。脂质颗粒与蛋白多糖的结合使其更容易被氧化或其它化学修饰,而LDL的氧化修饰被认为是动脉粥样硬化发生的重要步骤。早期内皮细胞产生的还原型辅 酶II氧化酶(NADPH oxidases)等参与LDL的氧化,随病变进展迁移至内膜下的巨噬细胞和平滑肌细胞产生的脂质加氧酶 (LOs)、髓过氧化物酶(MPO)等也参与脂质颗粒的氧化。 ②单核细胞的粘附与迁移 正常的内皮细胞有抑制血液细胞粘附的能力。但LDL颗粒蓄积部位的内皮细胞却需要吸引血液中巨噬细胞迁移至病灶部位吞噬和清除沉积的LDL。 病变部位的内皮细胞等表达P-选择素等促使血液中的单核细胞贴近血管壁以跳跃和滚动的形式行进,随后被内皮细胞等表达的血管细胞粘附分子-1(VCAM- 1 )和细胞间粘附分子-1(ICAM-1)等固定在病变部位的内皮细胞上。固定在内皮细胞的单核细胞需要接受新的信号以便准确迁移至病灶部 位。研究显示,内皮细胞在 氧化LDL等刺激因素的作用下可产生单核细胞趋化蛋白-1(MCP-1),而MCP-1能够选择性吸引单核细胞穿越内皮细胞间隙 进入内皮下并游至病灶部位。干扰素诱导蛋白10(IP-10)等则参与T-淋巴细胞向病灶部位的趋化和迁移。 ③泡沫细胞的形成 迁移至内皮下的单核细胞随后分化为巨噬细胞,修饰的LDL颗粒在该过程中起了重要作用。细胞表面的LDL受体是细胞摄取LDL-C的经典途径,但并不参与 泡沫细胞的形成。先天缺乏LDL受体的个体仍然可以产生泡沫细胞。细胞表面LDL受体数量受细胞摄取胆固醇量的调节,如果细胞摄取了足以满足其代谢需要的 胆固醇,则LDL受体数量下调以减少甚至停止LDL的进一步摄取。研究显示,巨噬细胞表面的清道夫受体介导脂质的过度摄取和泡沫细胞的形成。巨噬细胞通过 清道夫受体识别并吞噬修饰的LDL颗粒,该吞噬过程并不受所摄取胆固醇量的调节,可持续至大量脂质蓄积而形成泡沫细胞。其它受体包括CD36等亦可能参与 氧化LDL颗粒的清除和泡沫细胞的形成。病变部位的巨噬细胞集落刺激因子、白细胞介素-3以及粒细胞巨噬细胞集落刺激因子可诱导巨噬细胞增殖,以加快 LDL颗粒的清除。 巨噬细胞吞噬的胆固醇可通过HDL转运至内皮外,使巨噬细胞能够继续吞噬脂质颗粒,并最终完成清除工作。HDL有抑制泡沫细胞形成的作用并阻止动脉粥样硬化的进展。如果LDL沉积过多超过HDL转运能力,则巨噬细胞吞噬的脂质不断增多最终必然形成泡沫细胞直至死亡。大量的泡沫细胞沉积在动脉内皮下临床上可 表现为动脉粥样硬化的脂纹期。此时如果采取降低血LDL-C浓度、改善内皮功能等措施减少LDL等脂质颗粒在内皮下的沉积,通过HDL对胆固醇的逆转运, 动脉粥样硬化病变可能消失,反之LDL等脂质颗粒的沉积超过机体清除能力则病变继续进展,大量泡沫细胞死亡形成脂池并最终发展成典型的粥样斑 块。 有关他汀类药物临床试验中低密度脂蛋白胆固醇(LDL-C)水平与冠心病事件的关系研究支持了脂质浸润学说。该研究采用他汀类药物对高危患者进行一级和二级预防,使得发生冠心病事件的比率直线下降。说明血脂水平增高确实是冠心病发病的重要危险因素,两者呈直线相关关系。 ASTEROID 试验 研究结果 今年发表的ASTEROID试验结果证明,将LDL-C水平降到100 mg/dl的目标水平以下,当降至 到目前为止,无论人类还是动物,血脂是惟一可以用来干预,造成动脉粥样硬化动物模型,与临床实践有直接关系的危险因素。在诸多冠心病危险因素中,血脂仍然是最重要的危险因素。 ATPⅢ的JAMA述评 胆固醇假说已不再是假说。胆固醇水平异常可导致较高的死亡率和患病率,积极治疗可挽救生命已毋庸质疑。认真处理有冠心病或有冠心病危险成人的血脂异常是心 血管病治疗中必不可少的组成部分。脂质浸润学说虽然十分古老,但对于动脉硬化的发病和治疗都有重要的意义。ASTEROID试验中瑞舒伐他汀治疗后随访24个月时,血管内超声检测显示管腔面积由6.16 mm2减小到 5.96 mm2,动脉粥样硬化斑块面积由10.16 mm2减至5.81 mm2。  1.2 损伤-反应学说 损伤-反应学说针对的是斑块的增生及平滑肌细胞表形的改变,提出的根据是发现了血小板生长因子。 动脉粥样硬化早期病变主要涉及内皮功能改变、内皮下脂质沉积以及单核细胞和淋巴细胞的招募与聚集。粥样硬化病变进展至复杂斑块则有平滑肌细胞的参与。一旦 泡沫细胞大死亡并形成脂池,则可导致炎症性疾病的常见反映,对不能清除的病变进行包裹以减少病变对周围正常组织的影响。这个工作主要由平滑肌细胞完成。 平滑肌细胞主要分布在动脉的中层,通过一层弹力板与内膜隔开。平时也有少量平滑肌细胞分布在内膜,但粥样硬化病变部位的平滑肌细 胞主要是从中膜迁移而来。血小板衍生生长因子(PDGF)是引导平滑肌细胞迁移的主要趋化分子。从中膜迁移至内膜的平滑肌细胞聚集在由坏死的泡沫细胞组成 的脂池周围,由收缩型演变为合成型,在PDGF以及转换生长因子(TGF-β)等刺激下,产生构成细胞外基质的胶原纤维和弹力纤维组成纤维帽包绕脂池形成 典型的粥样硬化斑块。 1.3 内皮功能学说 由于近年发现内皮功能损害是动脉粥样硬化发病的首要和最早环节,因此内皮功能学说已经超越了损伤反应学说。现在知道,功能损害在解剖学损害之前很早就发生 了。最早发生于血管的是舒张功能受损,而这时内皮细胞、血管管壁没有任何显微镜下可见的病变,惟一的改变是一氧化氮(NO)释放减少,过氧化物增多,氧离 子增多,这些都只是功能性损害的表现。我们可以通过主动脉缺血后再灌注试验了解 NO释放减少的情况。 近年研究证明,机体对于血管内皮损伤的 重要反应机制是来自骨髓的内皮祖细胞修复功能,如果修复充分,则产生所谓“再生性炎症”,否则会发生“破坏性炎症”,加重内皮损伤和血管重构。当内皮功能 损害进一步加重时,可致其通透性升高,低密度脂蛋白、巨噬细胞渗透至管壁下,并释放细胞因子,召唤白细胞滚动、粘附在管壁内皮细胞上,与P选择蛋白、细胞 黏附因子、血管内皮基质相互粘附,相互作用。粘 附于管壁内皮细胞上的白细胞(以单核细胞为主)逐渐通过内皮细胞渗透进入管壁下,单核细胞在细胞因子的刺激 下变成巨噬细胞,进一步形成泡沫细胞,促使细胞生长因子释放,介导淋巴细胞聚集在损伤部位,而导致炎症效应,并共同促进炎症过程,促进平滑肌增生,内皮细 胞脱落,造成内皮细胞结构性损害。 与此同时,机体启动了内皮修复机制。来自骨髓的内皮祖细胞迁移至损伤部位,变成内皮细胞的前体细胞以填充脱落细胞的缺损。来自骨髓的多能干细 胞可分化为成血管细胞,并进一步分化成造血干细胞和成血管的内皮祖细胞。在血管部位的内皮祖细胞可分化为动脉或静脉的内皮祖细胞,分别构成动脉或静脉的血 管内皮。 来自骨髓的多能干细胞有两部分,其一为功能较强者,可通过生长性炎症,促使内皮祖细胞补充和完全修复破损的血管内皮,以促进体内平衡、自身稳定。另一部分 为功能不好的退化干细胞,如在老年冠心病患者中,内皮祖细胞的数量减少且功能状态不好,修复能力不强,可造成破坏性炎症,使动脉壁老化,血管壁异常重构。所以内皮细胞能否在血管壁发挥作用取决于干细胞的功能状态。 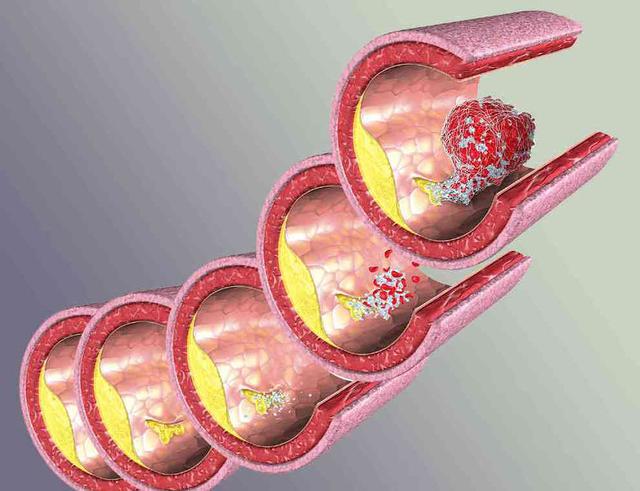 1.4 炎症学说(针对破坏机制) 炎症学说越来越受到重视,他针对的是急性冠脉综合征(ACS)时动脉粥样硬化斑块如何被破坏,即如何从稳定的斑块变成不稳定的斑块,直到斑块破裂。 PROVE IT-TIMI22研究 PROVE IT-TIMI22研究是比较8 mg/L洛伐他汀与4 mg/L普伐他汀降低低密度脂蛋白胆固醇(LDL-C)效果的临床试验,获得了阳性结果。其结果显示,单纯降脂或单纯抗炎,都不能很好地改善预后,只有当 LDL-C 炎症生化标志物 ACS 是一种多因素疾病,表现为炎症反应、斑块破裂、继发性血栓形成、进行性机械性梗阻以及血流动力学阻塞。越来越多的生物标志物被用于识别具有高危心血管事件 的ACS患者。炎症生物标志物有别于心肌坏死和血流动力学应激标志物,它提供的是ACS病理生理学发展过程的信息,能够定量评价心血管特异性炎症,可为临 床预测动脉粥样硬化及其并发症提供依据,因而其从众多的生物标志中脱颖而出,并备受关注。动脉粥样硬化斑块糜烂或破裂的过程有多种炎症机制参与,包括内 皮功能障碍、白细胞迁移、细胞外基质降解和血小板活化。 细胞因子和急性期反应物中 ① 调节白细胞活性的细胞因子,如白介素(IL)-6、10、18,单核细胞趋化蛋白(MCP)-1, 肿瘤坏死因子(TNF) -α, C反应蛋白(CRP), 血清淀粉样蛋白A (SAA)等都可能导致动脉粥样硬化斑块的发生。 ② 炎症急性期反应产物,如黏附分子中的可溶性细胞间黏附分子(sICAM)、可溶性血管细胞黏附分子sVCAM)、可溶性E选择蛋白(sE- selectin,E-S)能够促进单核细胞粘附以及白细胞渗入血管外间隙中,它们可提示内皮细胞的活化程度。ACS时血管性假血友病因子(von Willebrand,vWF)迅速增高也可能反映内皮细胞的活化。 ③ 内皮细胞激活和白细胞黏附标志物,如髓过氧化物酶(MPO)、分泌型磷脂酶A2 (sPLA2)、脂蛋白相关磷脂酶A2 (Lp-PLA2) 的血浆水平可能反映动脉粥样硬化斑块内的氧化应激程度。 ④ 氧化应激标志物,如血管内皮生长因子(VEGF)、胎盘生长因子 (PLGF)和肝细胞生长因子(HGF)都是有力的血管生长因子,容易引起斑块不稳定。同时,动脉粥样硬化斑块内的炎症应激亦可刺激血管生成,易导致斑块 内出血和斑块不稳定。 ⑤ 金属蛋白酶类,如基质金属蛋白酶(MMP)1、2、9,妊娠相关血浆蛋白(PAPP- A),斑块内炎症还会引起MMP活化, 分解胶原和弹力纤维等纤维帽的细胞外基质成分,降解纤维帽,从而使稳定斑块变得不稳定。 ⑥ 血小板激活和聚集标志物,如sCD40L、 可溶性P选择蛋白(sP-selectin,P-S)水平升高,加之不稳定斑块破裂和(或)糜烂可导致血栓形成。在未出现明显ACS之前,血小板也会被活 化,进而直接引起动脉粥样硬化的发生发展。 炎症损伤机制 LDL渗透入内皮细胞并滞留,经内皮细 胞氧化修饰为氧化低密度脂蛋白(oxLDL)后,成为对机体有害的物质,并被单核细胞吞噬。吞噬了oxLDL的单核细胞变为巨噬细胞,并在内毒素、热休克 蛋白等刺激下,分泌炎症细胞因子、蛋白酶、过氧阴离子等导致炎症反应,造成对组织的炎症损害。近年来,巨噬细胞在动脉粥样硬化斑块形成和发展中的作用引起 人们的重视。巨噬细胞是单核细胞粘附血管壁并 游离到内皮细胞下,吞噬oxLDL等后形成。炎症细胞中除了单核细胞外,淋巴细胞也很重要。辅助性T淋巴细胞 1型(Th1)可分泌有害的Th1细胞因子,引起炎症反应,促进动脉粥样硬化斑块的形成,对机体有害。调节T淋巴细胞可抑制Th1细胞因子的分泌,对机体 有益。在炎症反应中抗原递呈细胞也有重要作用,其在oxLDL、热休克蛋白、细菌、炎症反应等刺激下,可对Th1和调节性T淋巴细胞进行调控。 动 脉粥样硬化斑块可分泌干扰素-α、IL-1和TNF,脂肪组织也可分泌IL-1和TNF,它们可促进IL-6的分泌。IL-6是一种广泛存在的细胞因子, 对于白细胞和内皮细胞活化十分重要,它可促进肝脏急性期反应物的产生,如CRP、血清淀粉样蛋白A。IL-6在动脉粥样硬化斑块的肩区表达,通过刺激 MMP、MCP-1和(TNF) -α表达导致斑块不稳定。IL-6水平升高还能识别早期介入治疗最可能降低死亡危险的患者。这些结果提示,IL-6水平升高有助于识别病情较重的患者,积 极的治疗措施可能对这些患者更有益。 炎症因子、自身抗原、微生物等可刺激巨噬细胞、T淋巴细胞分泌促凝血因子、蛋白酶,分解斑块,造成斑块破裂,血栓形成。  1.5 遗传—环境相互作用学说(针对内因和外因) 遗 传—环境相互作用学说是近年来较受关注的学说。因为在此之前的学说不是针对疾病本身,就是强调控制环境因素。近年来由于遗传学和分子生物学的发展,使人们 注意到遗传和环境相互作用对发病的影响。研究显示,AS是基因—基因相互作用、环境—环境相互作用以及基因—环境相互作用的结果。深入研究这些相互作用, 对于AS的早期预警、早期预防、早期诊断和早期治疗将起重要作用。 动脉粥样硬化的遗传因素 对 小鼠实验研究有力提示,在动脉粥样硬化中遗传因素(即内因)在血管壁水平起作用 ( Circulation 2000;101:5-6,75-81 ) 。动脉粥样硬化涉及多种细胞和器官的各种不同生理过程,体内约有100余种基因影响动脉粥样硬化病变的形成。这些基因受环境因素和其他基因的影响而发生改 变。用双胞胎研究模型可以揭示影响心脏病及其危险因素的主要遗传因子的影响力。目前已知的有明显遗传成分的危险因子及其遗传度(遗传率)分别为:低密度脂 蛋白胆固醇(LDL-C)和极低密度脂蛋白胆固醇(VLDL-C)水平高(40%~60%),高密度脂蛋白胆固醇(HDL-C)水平低(45%~75%),甘油三酯水平高(40%~80%),高体质指数(25%~60%),高收缩压(50%~70%),高舒张压(50%~65%),脂蛋 白水平高(90%),同型半胱氨酸水平高(45%),2型糖尿病(40%~80%),纤维蛋白原水平高(20%~50%),CRP水平高(40%)。还有 性别、年龄和家 族史等。 2 动脉粥样硬化到组织缺血的发作 局灶性斑块的破裂和血栓形成是导致急性心血管事件的发生的核心。研究发现易损斑块最常见的病理学类型为:“发炎的”薄帽的纤维粥样斑块(thin-cap fibroatheroma, TCFA),约占60%~70%。另外30%~40%为蛋白多糖丰富的糜烂斑块。随着动物实 验和临床研究的进一步深入,易损斑块的发生、发展的分子生物学机制的研究方面已取得很大进展。而炎症反应是AS的核心因素。 2.1 动脉粥样斑块纤维帽的变化 粥样斑块处平滑肌细胞的数量和细胞外基质胶原、弹力纤维的含量对维持纤维帽的稳定性非常重要。在一些生长因子的作用下平滑肌细胞可出现增殖并产生构成动脉 粥样硬化斑块尤其纤维帽的细胞外基质。而许多炎症因子以及T淋巴细胞可诱导平滑肌细胞死亡,巨噬细胞等分泌的基质金属蛋白酶(MMP)等可分解胶原和弹力纤维等基质成分。平滑肌细胞增殖和死亡及基质成分的合成与分解的动态过程影响着动脉粥样斑块的发生和发展。如果细胞死亡大于增殖,基质的分解大于合成,纤维帽脆性变大易于破裂。 基质的降解在动脉粥样硬化发展过程中有着重要的作用。中层的平滑肌细胞要迁移至粥样病变处需要穿越内弹力板和致密的细胞外基质,而基质降解有利于平滑肌的 迁移。随着动脉粥样硬化病变的发展,血管首先出现外向型重塑(正向重塑),主要表现为血管壁的增厚和向外扩大而管腔并不狭窄。这种血管的重塑依赖于粥样斑 块基质的降解和重构。如果粥样斑块继续生长超过动脉横截面积的40%则开始出现负向重塑,血管腔出现狭窄。 2.2 斑块内的细胞凋亡 研究发现细胞凋亡参与了 AS 斑块形成和发展过程,在斑块中已检测出促凋亡基因 bax、Fas 和 p53 等的表达产物。Kolodgie 等利用 poE-/- 小鼠研究发现细胞凋亡是猝死小鼠破裂斑块中突出的病理生理学特征。Zadelaar 等在 ApoE-/-鼠中转染 Fas 配体,结果发现基因转染组细胞凋亡率和斑块破裂数明显增加,斑块纤维帽中细胞凋亡数是为转染组的 3 倍。本实验室通过转染 p53 基因诱发斑块破裂,TUNEL 检测发现破裂的斑块中细胞凋亡数明显增加,并且发现当斑块中侵入较多的巨噬细胞时,VSMC 凋亡增加,分泌的胶原数量减少,从而导致纤维帽变薄,这可能与巨噬细胞分泌 IL-1、TNFα 等细胞因子促进凋亡的发生有关。因此,不稳定斑块除了纤维帽较薄、有大量炎症细胞浸润以及有较大脂核外,还有一个特征就是纤维帽平滑肌细胞数量较 少。 2.3 斑块部位血管的再生 进展中的斑块在成纤维细胞生长因子、血管内皮生长因子以及胎盘生长因子等的作用下可出现较多新生血管。这些新生的微血管可为粥样 硬化斑块生长和稳定提供氧和营养成分,同时有利于单核细胞和淋巴细胞等进出斑块。但斑块中的这些微血管缺少正常基质的支撑以及发育不良,脆性较大且易于破 裂出血。斑块内出血可导致红细胞大量堆积,红细胞膜中富含胆固醇,死亡后可大量释出。斑块中新出现的胆固醇可再次激活炎症反应,吸引大量单核细胞浸润,单 核细胞在通过致密的纤维帽时可释放大量蛋白分解酶破坏基质成分以利向病灶迁移,但同时导致了纤维帽脆性的增加和斑块的不稳定。因此,斑块内新生血管破裂导 致的内出血可能是冠状动脉粥样硬化进展及斑块破裂的重要促进因素。 2. 4 动脉管腔的狭窄及临床并发症 动脉粥样硬化是一种缓慢进展性疾病,病程长达几年甚至几十年,其间大部分时间里病人可能没有临床症状。粥样硬化斑块形成后动脉壁 结构重塑,管壁首先外向扩张而管腔可以不出现狭窄,但如果斑块进展超过了一定程度则出现内向生长和管腔的狭窄。粥样斑块的进展扩大虽然缓慢,但并不是一个 连续的过程,而是呈跳跃性发展。一段静止期之后,在某些因素的作用下可突然进展扩大,如此反复。当病变进展导致管腔狭窄超过管腔直径60%,则超过冠状动 脉代偿扩张的能力而出现缺血的症状,临床上常表现为稳定劳累型心绞痛。 许多急性心肌梗死患者发病前并没有稳定型心绞痛病史而猝然发病,因为急性心肌梗死常常发生于轻中度狭窄而不是严重狭窄的斑块。一项研究资料显示,导致急性 心肌梗死的斑块其破裂前狭窄程度大多数在50%以下,仅15%大于60%。但是狭窄程度轻并不等于说斑块体积小,导致心梗的斑块体积可能很大,没有导致严 重狭窄是因为斑块部位动脉壁重塑呈外向型扩张的结果。严重狭窄斑块也可破裂导致急性心肌梗死,事实上严重狭窄斑块发生破裂的可能性并不低于较轻狭窄的病变,但轻中度狭窄斑块的绝对数量远高于严重狭窄斑块,因而在导致急性心肌梗死的罪犯病变中轻中度狭窄斑块占了绝大多数。 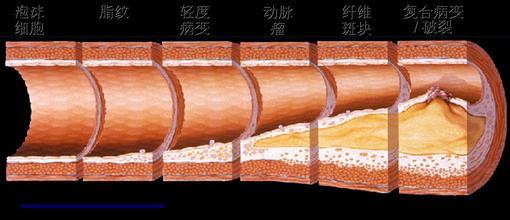 2.5 动脉粥样斑块与血栓 急性血栓形成是急性冠脉综合征的最主要病因,理解冠状动脉血栓形成的机制有着重要的意义。约三分之二的急性心肌梗死是由于斑块纤维帽破裂诱导 急性血栓形成所致。另有四分之一是由于斑块表面糜烂诱导急性血栓形成所致。糖尿病和女性患者似乎更容易出现斑块的糜烂。此外,粥样斑块的钙化结节侵蚀也可 引起急性血栓形成。 斑块内的胶原纤维是纤维帽抵御破裂保持其完整性的最主要物质。因此胶原纤维合成和分解的动态平衡影响着斑块的易损性。一些因素可干扰平滑肌细 胞合成胶原而影响纤维帽维持其完整性的能力。例如T淋巴细胞分泌的γ干扰素可抑制平滑肌细胞合成胶原,而TGF-β 和PDGF等则能够促进平 滑肌细胞对胶原的合成。另一方面,纤维帽主要构成成份胶原和弹力纤维等降解过快也可削弱斑块的稳定性,使其容易破裂而诱发血栓事件。胶原和弹力纤维等基质 成份的降解主要由巨噬细胞分泌的基质金属蛋白酶、胶原酶和弹性蛋白酶等完成。基质的降解参与动脉壁的重塑并有利于平滑肌细胞与炎症细胞穿越致密组织向病变 部位迁移,但同时也使纤维帽变薄、脆性增加导致斑块不稳定。较大的脂核也增加斑块的不稳定性,从生物力学的观点看,脂核越大越易将血压等外力集中于斑块的 肩部,而肩部是斑块最常见破裂点。 局部血栓形成是机体对破裂斑块的正常生理防护反应。研究显示,冠状动脉粥样硬化斑块有着相当高的破裂发生率,而同一患者往往同时存在多处破裂 斑块,但是并非每一次斑块破裂和继发血栓形成都会导致临床冠脉事件,多数情况下形成的血栓较小,对血流没有造成明显影响,从血栓形成到修复结束患者没有任 何临床症状。影响血栓大小的因素很多,例如血液是否处于高凝状态、斑块破裂口的大小以及斑块破裂后所暴露的促栓因子(胶原和组织因子等)的多少 等。 这些富含血小板的血栓虽然不一定导致临床冠脉事件,但在动脉粥样硬化病变进展和斑块扩大中扮演了重要角色。血小板所释放的TGF-β和 PDGF等可刺激平滑肌细胞迁移、增殖及合成基质。血栓中的凝血酶也有很强的刺激平滑肌细胞增殖的作用。这种突发的血栓事件是仅是斑块由静态转变为急性进 展过程中的一种表现,也体现了动脉粥样病变呈现出跳跃性进展的特性。其他一些因素,如上所述斑块内新生血管破裂导致的斑块内出血也可诱发斑块的急性进展扩 大破裂而至血栓形成。 总之,动脉粥样硬化是一种慢性炎症性疾病。内皮损伤或血清胆固醇水平过高导致大量以LDL为主的脂质颗粒沉积于动脉内皮下;这些沉积的脂质颗粒随后被修饰 标记并吸引血液中的单核细胞、淋巴细胞等迁移至内皮下;迁移至内皮下的单核细胞转化为巨噬细胞并大量吞噬修饰的脂质颗粒;如果超过HDL等把胆固醇向内膜 外转运的能力,则巨噬细胞形成的泡沫细胞最终死亡;大量死亡泡沫细胞聚集形成脂池并吸引动脉中层的平滑肌细胞迁移至内膜,随后平滑肌细胞由收缩型衍变为合 成型并产生大量胶原和弹力纤维等包裹脂池形成典型粥样硬化病变。 动脉粥样斑块 在oxLDL 的促进 AS 过程中的炎症反应,炎症反应对内皮损伤的启动,斑块内细胞凋亡、新生血管的形成、血管重构和斑块所受的应力和血流剪切力作用,最终导致斑块的损伤,从而局 部急性血栓形成而引起组织的缺血、缺氧损伤和坏死的心、脑、肾及周围血管等器官的临床综合症。 |
|