
胰岛素是由人体胰岛β细胞分泌的,是体内惟一具有降血糖作用的激素。注射胰岛素是糖尿病治疗的重要手段,但目前还有许多患者对胰岛素的认识存在误区,认为“打上胰岛素会上瘾”,许多糖尿病患者对胰岛素的抵触,导致治疗时机延误。因此,应教育患者正确认识胰岛素的治疗作用。

误区一:能不用胰岛素就不用胰岛素
许多患者从心理上抵触注射胰岛素,错误的认为胰岛素一旦使用上,就表示病情已相当严重。其实胰岛素治疗能给病人带来很大好处。首先,胰岛素治疗能使病人的病情获得最好的控制,使其糖、蛋白、脂肪、水钠及酸碱代谢平衡维持正常,防止或延缓糖尿病急性和慢性并发症的发生与发展,使病人维持良好的状态,维持正常的生长、生活与工作;另外,胰岛素治疗是一种最生理的疗法,一种对肝、肾、胃肠影响最小的糖尿病治疗方式,也就是说它的副作用最小。此外,口服药物并不适合所有糖尿病患者,对于某些患者来说,胰岛素是最容易和最佳的给药方式。

误区二:用胰岛素会上瘾
在临床工作中,医生在劝说有指征的2型糖尿病患者注射胰岛素治疗时,很多病人常常觉得难以接受,并拒绝胰岛素治疗,理由大多是“打了胰岛素,以后就会形成胰岛素依赖”,其实这些都是错误的观念。胰岛素是人体内正常存在的一种激素,注射胰岛素只是一种通过补充外源性胰岛素来控制血糖的临床治疗手段,就像体内缺少维生素,我们补充维生素来达到治疗和保健的目的。认为打了胰岛素后就会依赖胰岛素,就会“上瘾”的观点更是毫无科学依据。
误区三:用了胰岛素,用量会越来越大,不能再回用口服药了

临床上经常有2型糖尿病患者经饮食控制及最大量口服降糖药仍不能控制血糖或处于感染、急性心脑血管意外等状态,经过一段时间的胰岛素注射治疗,调节内环境之后,不但糖尿病得到控制,还可以逐渐将胰岛素减量乃至撤掉再改口服降糖药,并获得良好的血糖控制。2型糖尿病应用胰岛素后对于能否改回口服药要分情况而论:第一种情况,病人真正缺乏胰岛素,应用胰岛素治疗后就停不下来,口服降糖药是无法很好控制此类病人的血糖情况的。第二种情况,由于高血糖破坏了胰岛细胞,导致胰岛素缺乏,此种情况下应用胰岛素控制血糖约3个月后,人体胰岛素分泌可恢复正常,因此应用一段时间后可改回口服降糖药。若要知道是属于哪一种情况,则需检查血中的胰岛素水平。
 胰岛素是一种激素,那些通过血液循环或组织液起传递信息作用的化学物质,都称为激素。激素的分泌均极其微量,大都为毫微克(十亿分之一克)级别,但它们的调节作用却极为显著。
胰岛素是一种激素,那些通过血液循环或组织液起传递信息作用的化学物质,都称为激素。激素的分泌均极其微量,大都为毫微克(十亿分之一克)级别,但它们的调节作用却极为显著。
激素能起到各种调解作用,是由于靶细胞表面有接受这种激素的受体,对胰岛素来说,这就是细胞表面的胰岛素受体。它就是胰岛素作用的靶点,而且这种他们俩结合特异性非常高,基本不会错:
由于胰岛素分泌量极其少,细胞想要接收到这些激素信号还挺难的。
打个比方,这就像去火车站接人,如果车站人太多挤到爆,为了能确保接到目标,必须加派人手;当火车站的人比较少的时候,为了节约开支,也可适当减少接站人员。
细胞也是一样的,细胞表面的胰岛素受体数量会随着血液中胰岛素浓度的变化而变化,保证既能够接受到胰岛素,又不浪费蛋白质来合成多余受体。
所以我们空腹的时候,胰岛素是呈脉冲的方式分泌的,脉冲周期大约为13分钟一次。
为什么样这样呢?
这种模式既防止分泌过多出现高胰岛素血症,导致靶组织中胰岛素受体数量下调,以维持胰岛素的敏感性;又防止胰岛素分泌过少,细胞对胰岛素过于敏感而出现其他问题,而且没事儿就分泌一下,也可以和细胞们沟通一下感情,不然感情都生分了。
而且我们之前说过,胰岛素还有一个相爱相杀的兄弟--胰高血糖素。当胰岛素分泌过多,血糖浓度低于正常水平时,胰岛素的分泌减少或停止,同时胰高血糖素分泌增加,使血糖水平上升。当然还有其他的激素参与调解空腹胰岛素的分泌量。
这就是空腹胰岛素的分泌模式
那吃饭的时候呢?
当我们进餐开始,其实胰岛细胞就已经开始准备工作了。我们知道,内脏器官虽然不受我们自主调控,但是还是受到其他神经和激素调剂的。
当食物通过口腔咀嚼和食管吞咽进入胃肠中,小肠开始蠕动消化食物。这时候,小肠会分泌胰升糖素肽和抑胃肽。这两种激素都有促进胰岛素分泌的功能,也就是说在我们摄入的碳水化合物还没有开始大规模消化的时候,已经有催促胰岛素分泌的通讯兵出发了。
这时候胰岛β细胞中大概是这个样子:
胰岛β细胞开始不紧不慢的生产胰岛素。
小肠蠕动的过程中,肠迷走神经兴奋,可直接刺激胰岛素的分泌。
如果说激素调节相当于不同部门之间发函沟通,速度较慢的话,那神经调节就相当于总部直接给生产部打电话。部门之间相互扯皮还可以理解,老总的话你敢不听吗?
这下胰岛细胞不敢怠慢,开始全力生产胰岛素了。
随着碳水化合物在小肠中被降解为葡萄糖小分子,然后被小肠上皮细胞吸收入血液,血糖浓度大幅度上升。这些高浓度的随血液循环的葡萄糖在路过胰腺的时候,被胰岛β细胞准确的感知,最主要、最激烈的胰岛素刺激来了!
“我擦,这么多葡萄糖!!!!”
“兄弟们,开足马力,加班加点!!”
当普通的口号不再起作用的时候,只能祭出大杀器了:
“人有多大胆,地有多高产!”
“三年超英,五年赶美!”
“一天等于20年,跑步进入共 产主义!”
“争取亩产三万六千斤!”
胰岛开始疯狂运转起来,这就是刺激胰岛素分泌最主要的方式:
葡萄糖刺激的胰岛素分泌
具体过程是怎样的呢?
当血糖水平太高时,葡萄糖分子能够通过一个名为GLUT的葡萄糖转运蛋白跨过细胞膜进入β细胞内,并被迅速用于产生能量,这个代谢过程进而引发一系列的化学反应,最终激活胰岛素基因的表达增加,导致胰岛素大量释放。这套高血糖-胰岛素分泌的系统可以非常灵敏的监测到血糖水平的异常升高,然后释放相应数量的胰岛素。
大致过程如图所示:
随着胰岛β细胞超负荷地运转,大量的胰岛素被生产出来,释放入血液。这些胰岛素分别于机体其他细胞表面的胰岛素受体结合,开始发挥作用。
随后这些高浓度的血糖被细胞吸收,血糖下降,并且恢复平稳。一天下来,整个情况大概是这样子:
当然能够刺激胰岛素分泌的不仅仅是葡萄糖,许多氨基酸都有刺激胰岛素分泌的作用,其中以精氨酸和赖氨酸的作用最强。
这就是整个胰岛素刺激和分泌的过程
整个过程中间任何一个环节出问题,都会导致身体胰岛素分泌缺陷,那有哪些因素会导致胰岛素分泌不正常呢?糖尿病患者的体内胰岛素相对缺乏,所以注射胰岛素可以快速控制血糖,稳定病情,在合理使用的前提下,胰岛素对血糖控制以及对糖尿病并发症的预防效果都是最好的,而且副作用也非常少。但是为什么老王会发生这种情况呢?原因有两个。
1、体重增加
使用胰岛素的过程中,糖尿病患者会有变胖的情况。因为胰岛素可以促进组织对血糖的吸收和利用,以降低血糖。但是在利用过程中,会把一部分血糖转化为脂肪储存起来,所以会导致患者发胖。在初期进行胰岛素治疗时,医生也常用患者体重是否增加来判定胰岛素治疗是否有效。
但体重增加会加重胰岛素抵抗,会使胰岛素的用量增加,造成血糖控制困难,所以糖尿病患者保持正常体重非常重要。这就要求糖尿病患者在接受胰岛素治疗的同时,还要配合饮食控制和运动治疗。并且可以联合使用双胍类、葡萄糖苷酶抑制剂、SLGT-2抑制剂、GLP-1激动剂等降糖药物,可以减少胰岛素的用量,控制体重增加。

2、皮下脂肪增生
老王肚子变大,血糖控制变差的原因,除了发胖之外,还有一个可能是发生了皮下脂肪增生。长期注射胰岛素的患者,由于胰岛素的作用,在注射部位会出现皮下脂肪增生或萎缩,使局部皮肤隆起或是凹陷。这两种情况都会影响胰岛素的吸收,导致血糖水平发生波动。
造成皮下脂肪增生或是萎缩的情况,常见于胰岛素纯度不够和长期固定同一注射部位所导致。解决方法是,选择生物合成高纯度的人胰岛素,以及经常轮换注射部位。除了腹部之外,还有上臂外侧、大腿外侧等部位可以注射。
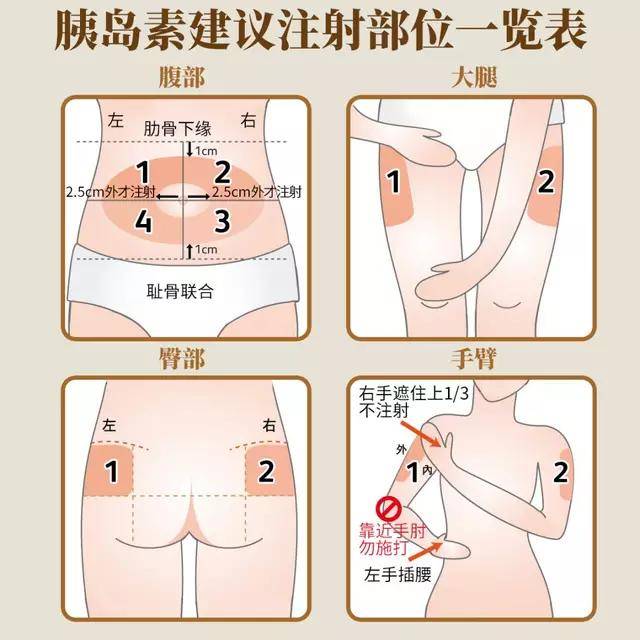
使用胰岛素者要预防低血糖
注射胰岛素的糖尿病患者,除了注意体重增加和皮下脂肪增生,更重要的事情是要预防低血糖。低血糖是使用胰岛素的糖尿病患者最常见的副作用,轻度低血糖只会引起心慌、出汗、头晕和无力;重度低血糖就会引起精神异常、昏迷,甚至会有生命危险。常见于胰岛素用量过大,或是用药后未及时进餐,以及运动量突然加大的糖尿病患者。
所以糖尿病患者要协调好胰岛素用量、饮食和运动的三者关系,尽量保持规律生活方式,计算好每餐进食的总热量,做到定量进餐,不要随意增加每天运动的强度,也不要随意增加用药剂量。更重要的是要学会及时识别低血糖,随身携带糖块或小点心,在发生低血糖的时候及时食用。

总结一下,长期使用胰岛素的糖尿病患者,在发现自己肚子变大,血糖控制变差的时候,很可能是发胖和发生了皮下脂肪增生。需要及时干预,但调整降糖药物的用量需要在医生的指导之下,不要自己随意增量,避免发生低血糖。
虽然大多数的胰岛素及其类似物注射液目前已设计成预填充注射笔,大大改善了患者的使用体验,但是长期皮下注射常伴随疼痛、局部组织坏死、感染及神经损伤等不良反应。
其中最大的“不良反应”就是天天要打针:
为提高了糖尿病患者的用药体验,胰岛素的非注射给药系统在近几年得到广泛的研究。不打针,而是通过其他的方式将胰岛素送入血液中。
那一般有哪些方式呢?
胰岛素给药新剂型,包括口服、经鼻、眼睛粘膜、经肺、经皮、可注射原位凝胶和闭环给药。
看到了没有,胰岛素可不仅仅是只能注射进入体内,各种纷繁复杂的给药方式都在科学家的研究范围之内。
咱接下来看看
真的有非注射型的胰岛素药吗?
我们知道,现在的胰岛素都是通过基因重组技术(转基因)得到的胰岛素类似物,改变了人胰岛素中的部分氨基酸结构,具有速、中、长效降血糖的不同效果。
临床上通过联合使用具有不同降血糖效果的胰岛素类似物,从而以模拟正常人体内胰岛素的分泌模式,达到良好的血糖控制效果。
那这些基因重组胰岛素一般包括哪些呢?
诺和诺德公司研发的门冬胰岛素,商品名诺和锐(NovoLog),为速效胰岛素。地特胰岛素,商品名诺和平(Levemir),是长效胰岛素。
赛诺菲-安万特公司研发的谷赖胰岛素,商品名艾倍得(Apidra),是速效胰岛素;甘精胰岛素,商品名来得时(Lantus),是长效胰岛素。
礼来公司研发的赖脯胰岛素,商品名优泌乐(Humalog),是速效胰岛素;优泌乐25(Humalog Mix 75/25)是由25%赖脯胰岛素和75%精蛋白锌赖脯胰岛素混合而成的注射液,是一种短中效结合的胰岛素
大概是这样:
从上图中这些已经上市的胰岛素列表可见,目前已经有一个非注射剂型上市,即MannKind公司的胰岛素肺吸入剂Afrezza 。
这个药是FDA批准其用于1型和2型糖尿病患者在就餐时间段的胰岛素给药,该药品不能替代长效胰岛素,而且具有肺吸入给药的所有不良反应,但它仍为数量庞大的糖尿病患者群提供了较方便的治疗方式。
所以非注射型胰岛素是存在的
那除了肺吸入剂外
还有哪些给药的方式呢?
正在进行临床研究的胰岛素新型递药系统如下图所示:
1口服胰岛素
口服给药方便经济、完全无痛,患者依从性好,对于经常需要注射胰岛素的患者来说非常有诱惑力。
但作为相对分子量大、半衰期短、脂溶性差的多肽蛋白类药物,胰岛素直接口服会存在3个屏障:
①物理屏障,即胃肠道上皮细胞会阻碍胰岛素的吸收。
②化学屏障,即从高酸性的胃部环境到中性至微碱性的肠道环境的变化会导 胰岛素 内部结构破坏。
③酶屏障,即胃肠道中的蛋白酶会降解胰岛素,致其失活。
因此,目前研究中常利用脂质体、纳米粒、微球、微囊和凝胶等载体减少胃肠道环境对胰岛素的破坏和降解,并且添加促吸收剂促进其有效吸收,期望其能作为生物大分子的口服传递载体。
目前并没有口服胰岛素制剂上市。
2经鼻给药
人体的鼻腔黏膜的表面积约为150cm2,黏膜细胞下有丰富的血管和淋巴管,胰岛素蛋白通过黏膜吸收后可直接进入体循环。
但与口服给药相似,鼻腔给药也存在一些障碍,包括鼻道对药物的清除、黏液层和鼻腔上皮细胞的阻碍和鼻腔内的酶降解等。
3肺部吸收
肺部具有吸收表面积大(约140m2)、血管丰富、上皮细胞屏障较薄(肺泡柱状上皮细胞的厚度0.1~0.2mm )、膜通透性高和酶活性较低的特点,有助于药物快速吸收。
这样给药跟抽烟有点类似。
当然肺部吸收也有障碍:
覆盖在肺泡上皮细胞、厚度1~10微米的黏液是胰岛素经肺吸收的物理屏障,胰岛素会被黏膜中存在的巨噬细胞和多种代谢酶清除或代谢。
除生理因素外,影响胰岛素吸入的主要因素是颗粒尺寸。
随着药物颗粒大小不同,沉积部位也不同,直径1~3微米时主要沉积在肺泡或肺深部。
4经皮给药
多肽、蛋白类药物的经皮给药须借助微针或离子导入技术。
微针可在皮肤的角质层和表皮层创建微米级、暂时性的亲水通道,帮助亲水性的小分子药物、多肽、蛋白质和纳米粒等透过皮肤,使药物通过真皮层吸收进入体循环。
勉强算是微创给药,没有打针这么疼。
5 可注射原位温敏水凝胶系统
虽然速效胰岛素与长效胰岛素的联合使用可控制血糖,但不能完全避免夜间或空腹时段低血糖的危险。
为解决该问题,实现单次注射后胰岛素的稳定、长效释放,科学家们等开发了可注射的原位温敏水凝胶缓释体系。
这套系统能够有效控制胰岛素的释放速度,糖尿病模型大鼠注射1次后,3个月内可维持基础胰岛素水平,且不会引起任何免疫反应,有望替代目前每天注射几次胰岛素的麻烦。
6智能给药闭环
只能闭环胰岛素递药系统可模仿正常胰腺的功能,实现胰岛素递送速率和递送剂量的自我调节,减少患者血糖波动,并控制低血糖风险,与胰岛素泵类似。
目前大部分的闭环胰岛素是由聚合物生物材料开发而来,通过化学控制的方式实现。
胰岛素通常被包埋在葡萄糖响应型聚合物系统(如葡萄糖氧化酶、苯硼酸、葡萄糖结合蛋白)中。通过聚合物结构变化、聚合物降解或葡萄糖结合竞争,可调节胰岛素的释放速率。
眼粘膜、直肠粘膜给药也是正在研究的途径。
这就是胰岛素的其他给药途径
那现在上市的多吗?
这些非注射给药途径虽然能克服传统的皮下注射给药的缺点,有效改善糖尿病患者的用药顺应性和生活质量,但要真正实现临床运用,仍面临许多困难,所以很多药物仍然在进行临床试验。
所以我们只能等待它们通过严格的临床试验,然后被FDA或者CFDA批准之后方可遵医嘱购买,私下擅自用药不仅风险较大而且容易被骗。